PUNTOS CLAVE
- Dada la importancia del sueño para un óptimo rendimiento y salud, se han investigado un gran número de intervenciones nutricionales para determinar su efectividad en el mejoramiento de la cantidad y calidad del sueño.
- Como algunas de las intervenciones nutricionales pueden ejercer efectos sobre los neurotransmisores que están involucrados en el ciclo de sueño-vigilia, es posible que estas intervenciones puedan mejorar el sueño.
- Los alimentos con alto índice glicémico pueden ser beneficiosos para mejorar el sueño si se consumen más de 1 hora antes de acostarse y comidas sólidas pueden ser mejores que las comidas líquidas para optimizar el sueño.
- Con base en la literatura actual, parece que las dietas ricas en carbohidratos pueden dar lugar a latencias más cortas de sueño, mientras que las dietas altas en proteínas pueden resultar en una mejor calidad de sueño y las dietas altas en grasas pueden influir negativamente en el tiempo total de sueño.
- El triptófano, la metionina y la valeriana son otras sustancias que tienen alguna evidencia científica para mejorar el sueño.
ANTECEDENTES
Aunque no se entiende completamente la función exacta del sueño, éste tiene funciones biológicas extremadamente importantes. Esto se demuestra por los efectos negativos que la privación del sueño puede tener sobre el rendimiento, el aprendizaje, la memoria, la cognición, la percepción del dolor, la inmunidad, la inflamación, el metabolismo de la glucosa y la función neuroendócrina. Un gran número de sustancias nutricionales han sido asociadas de manera tradicional con la promoción del sueño. Los investigadores han comenzado recientemente a estudiar su eficacia como un sustituto de las intervenciones farmacológicas.
Aunque no se entiende completamente la función exacta del sueño, éste tiene funciones biológicas extremadamente importantes. Esto se demuestra por los efectos negativos que la privación del sueño puede tener sobre el rendimiento, el aprendizaje, la memoria, la cognición, la percepción del dolor, la inmunidad, la inflamación, el metabolismo de la glucosa y la función neuroendócrina. Un gran número de sustancias nutricionales han sido asociadas de manera tradicional con la promoción del sueño. Los investigadores han comenzado recientemente a estudiar su eficacia como un sustituto de las intervenciones farmacológicas.
REVISIÓN DEL SUEÑO
Etapas del sueño
El sueño se puede definir como un estado conductual reversible donde un individuo está perceptualmente desconectado del medio ambiente y no responde a él (Carskadon y Demet, 2011). Dormir es un estado conductual y fisiológico complejo que tiene dos estados básicos basados en parámetros fisiológicos. Estos son el estado de movimiento ocular rápido (REM por sus siglas en inglés) y no REM (NREM). Para identificar los dos estados se utiliza un electroencefalograma (EEG), en el que los electrodos miden la actividad eléctrica cerebral (Figura 1). El sueño NREM se divide en cuatro etapas (1-4) que están asociadas con un aumento progresivo de la profundidad del sueño (Carskadon y Dement, 2011). El sueño REM se caracteriza por la atonía muscular, periodos de movimiento ocular rápido y los sueños. Por lo tanto, el sueño REM es un cerebro activo en un cuerpo paralizado.
Medición del sueño
Existen dos métodos utilizados comúnmente para evaluar el sueño. El primero es la actigrafía que involucra monitores en la muñeca, los cuales se ponen como reloj de pulsera que registra continuamente el movimiento corporal (almacenado generalmente en periodos de 1 min), y el registro de diarios del sueño, donde los participantes registran los tiempos iniciales y finales y las fechas de todos los periodos de sueño (es decir, sueño nocturno y siestas durante el día). Los datos de los diarios de sueño y los monitores de actividad se utilizan para determinar cuándo los participantes están despiertos o dormidos. Esencialmente, todo el tiempo se registra como despierto a menos que: (i) el diario de sueño indique que el participante estaba acostado intentando dormir y (ii) la actividad registrada en el monitor es suficientemente baja para indicar que el participante estaba inmóvil. Cuando estas dos condiciones se cumplen de manera simultánea, el tiempo se cuenta como sueño. La actigrafía es útil para entender los patrones de sueño ya que es una forma no invasiva y relativamente fácil de recolectar datos sobre periodos de tiempo significativos (comúnmente 2 semanas de monitoreo).
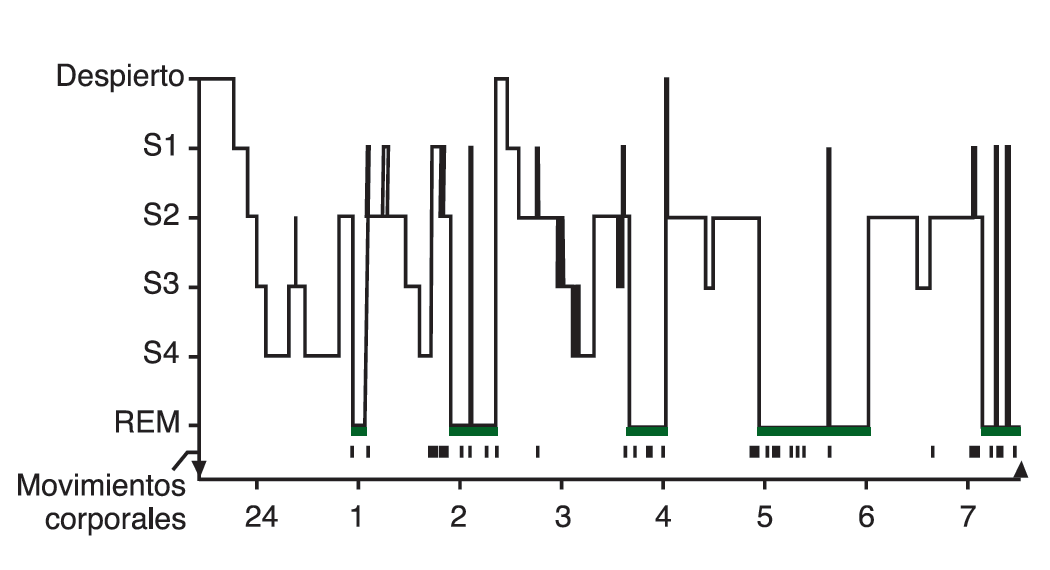
Figura 1. Se ilustra en el histograma de sueño la progresión de las etapas de sueño a lo largo de una sola noche en un adulto joven voluntario. El texto describe el patrón ideal o promedio (Carskadon y Dement, 2011).
El segundo método es la polisomnografía (PSG), por la cual se miden funciones corporales tales como la actividad cerebral (EEG), movimientos oculares (EOG), actividad muscular (EMG) y actividad cardiaca (ECG). La PSG proporciona información sobre la etapa de sueño y se considera el "patrón de referencia" para la evaluación cuantitativa y cualitativa del sueño. La PSG puede ser costosa, requiere mucho trabajo y generalmente se utiliza para la evaluación clínica de trastornos del sueño.
INTERVENCIONES NUTRICIONALES PARA MEJORAR EL SUEÑO
Existen varios neurotransmisores en el cerebro que están involucrados en el ciclo sueño-vigilia. Estos incluyen a la serotonina, ácido gama aminobutírico (GABA), orexina, hormona concentradora de melanina, colinérgico, galanina, noradrenalina e histamina (Saper et al., 2005). Por lo tanto, es posible que las intervenciones nutricionales que actúan sobre estos neurotransmisores en el cerebro podrían también influir sobre el sueño.
Los precursores dietéticos pueden influenciar la tasa de síntesis y función de un pequeño número de neurotransmisores, incluyendo a la serotonina (Silber y Schmitt, 2010). La Figura 2 de abajo resalta los medios por los cuales la dieta podría influenciar al sistema nervioso central y a través de la producción de serotonina (5-HT) y metionina. La síntesis de 5-HT es dependiente de la disponibilidad de su precursor en el cerebro, el aminoácido L-triptófano (Trp). El Trp se transporta a través de la barrera hematoencefálica por un sistema que comparte otros transportadores que incluyen varios aminoácidos neutros largos (LNAA por sus siglas en inglés). Por lo tanto, el índice de Trp/LNAA en sangre es crucial para el transporte de Trp hacia el cerebro y se puede lograr un incremento en este índice consumiendo triptófano puro o proteína rica en triptófano (Silber y Schmitt, 2010). La proteína proveniente de alimentos con el contenido más alto de Trp y la relación más favorable de Trp:LNAA es la α-lactoalbúmina, una proteína derivada de suero de leche (Heine, 1999). La ingesta de otras formas de proteína generalmente disminuye la absorción de Trp en el cerebro, ya que el Trp es el aminoácido menos abundante y por lo tanto, otros LNAA son transportados preferentemente al interior del cerebro. Sin embargo, los carbohidratos aumentan el Trp en el cerebro mediante la estimulación de la insulina de los LNAA hacia el músculo esquelético, lo que resulta en un incremento del Trp libre (Fernstrom y Wurtman, 1971).
Carbohidratos
Un pequeño número de estudios han investigado los efectos de la ingesta de carbohidratos (CHO) sobre los índices de calidad y cantidad del sueño. Porter y Horne (1981) suministraron a seis sujetos masculinos, ya sea una comida alta en CHO (130 g), una comida baja en CHO (47 g) o una comida que no contenía CHO, 45 minutos antes de dormir. La comida alta en CHO produjo un aumento en el sueño REM y una disminución del sueño ligero y vigilia (Porter y Horne, 1981). No obstante, en este estudio el contenido calórico de las comidas no fue igual por lo que fue imposible decir si el efecto se debió a los carbohidratos o a las calorías.
También se ha estudiado el efecto de la comida vs. bebida (con un contenido alto, medio o bajo de CHO) vs. agua a diversos intervalos de tiempo antes de dormir (Orr et al., 1997). Los resultados demostraron que las comidas sólidas mejoran la latencia inicial del sueño (tiempo necesario para conciliar el sueño) hasta 3 horas después del consumo y las comidas líquidas fueron ligeramente mejores que el agua. No hubo ningún efecto de la composición de la comida o bebida sobre el sueño. A partir de este estudio, no se puede concluir que los efectos observados son efecto de los carbohidratos o de la energía.
Afaghi y colaboradores (2007, 2008) llevaron a cabo dos estudios en los cuales investigaron el consumo de carbohidratos antes de dormir en hombres sanos. En el primer estudio, se dieron comidas con alto o bajo índice glicémico (IG) 4 h o 1 h antes de dormir (Afaghi et al., 2007). La comida con alto IG mejoró significativamente la latencia inicial del sueño en comparación con la de una comida de bajo IG. Además, proporcionar la comida 4 h antes de dormir fue mejor que la comida 1 h antes de dormir. En el segundo estudio, se comparó una comida muy baja en CHO (1% CHO, 61% grasas, 38% proteína) con una comida control (72% de HCO, 12.5% grasas, 15.5% proteína) con la misma energía, 4 h antes de dormir (Afaghi et al., 2008). La comida muy baja en CHO incrementó el porcentaje de tiempo usado en el sueño de ondas lentas (etapas 3 y 4 de NREM) y el tiempo gastado en sueño REM al comparar con la condición control. Finalmente, Jalilolghadr y colaboradores (2011) proporcionaron a ocho niños una bebida con alto IG (200 mL de leche y glucosa) o bajo IG (200 mL de leche y miel), 1 h antes de dormir. En este estudio, la bebida con alto IG aumentó la excitación en mayor medida que la bebida con bajo IG, implicando una baja calidad de sueño.
De la naturaleza limitada y algo contradictoria de los estudios anteriores, parece que los alimentos con alto IG pueden ser beneficiosos si se consumen más de 1 h antes de dormir, y que las comidas sólidas pueden ser mejores que las comidas líquidas para mejorar el sueño.
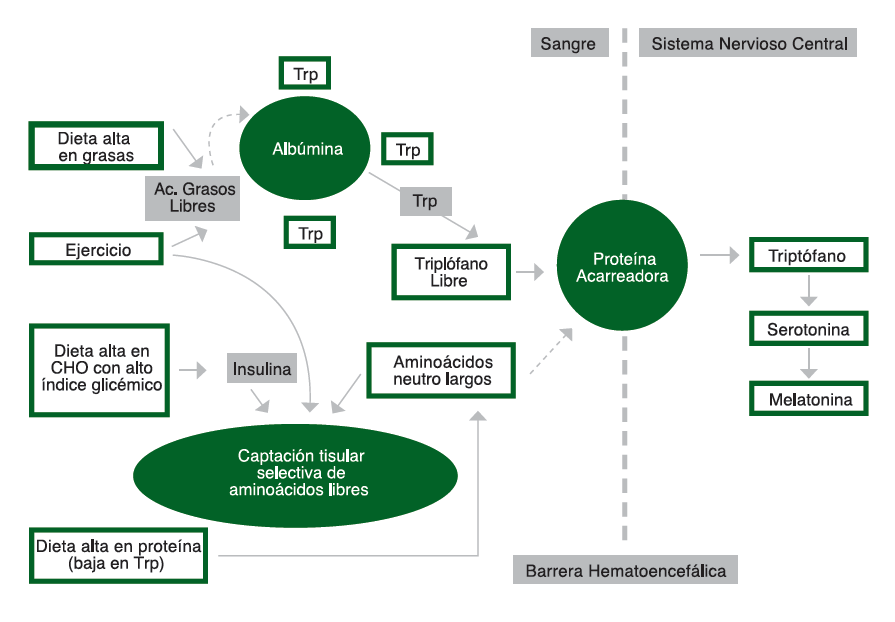
Figura 2. Efecto de la dieta sobre la absorción de triptófano (Trp) y el sistema nervioso central. Adaptado de Grimmett y Sillence (2005).
Efecto agudo de las comidas con composición mixta
Sólo un pequeño número de estudios han investigado los efectos de las comidas o bebidas de diferente composición sobre el sueño. Hartmann y colaboradores (1979) suministraron una bebida con la cena ya sea alta en grasas (90 g), alta en CHO (223 g) o alta en proteína (30 g). Los resultados no revelaron ningún efecto de las bebidas sobre el sueño al comparar con no consumir ninguna bebida. Zammit y colaboradores (1995) examinaron los efectos de comidas líquidas de alto o bajo contenido de energía (993.5 vs. 306 Kcal) administradas en el almuerzo, en comparación con ninguna comida sobre las siestas durante el día. Se demostró un aumento de tiempo en las etapas 2 y 3 del sueño NREM con ambas comidas líquidas en comparación con ninguna comida. Sin embargo, no hubo diferencias en la latencia inicial de sueño (Zammit et al., 1995).
Una vez más, hay muy poca investigación en esta área, pero parece que la ingesta calórica reducida puede dar lugar a mala calidad de sueño.
Dieta habitual
Los estudios antes mencionados, han examinado las manipulaciones nutricionales agudas en el sueño. También se han llevado a cabo estudios que investigan manipulaciones crónicas o el consumo dietético habitual. Kwan y colaboradores (1986) proporcionaron a seis mujeres sanas, una dieta baja en CHO (50 g/día) por 7 días y reportaron un incremento en la latencia REM en comparación con el patrón de sueño antes de la intervención de 7 días cuando las participantes consumían su dieta habitual. Lacey y colaboradores (1978) también estudiaron mujeres por 7 días, ya sea con un consumo diario alto en proteína, bajo en proteína o normal. Los resultados mostraron que un consumo elevado de proteínas produce un aumento en la inquietud, mientras que consumos bajos de proteína produjeron cantidades reducidas de sueño de ondas lentas. No obstante, no hubo diferencias en el tiempo total de sueño (Lacey et al., 1978). Aunque es difícil sacar conclusiones definitivas de este estudio, es evidente que alterando el consumo diario de proteína puede afectar la calidad del sueño.
En un amplio estudio reciente, Lindseth et al. (2011) manipularon la dieta de 44 adultos por 4 días. Las dietas fueron ya sea altas en proteína, altas en CHO o altas en grasas. Las dietas altas en CHO resultaron en latencias iniciales de sueño más cortas y las dietas altas en proteína produjeron un menor número de episodios de vigilia. Hubo poco efecto de la dieta alta en grasas en los marcadores de la calidad y cantidad de sueño (Lindseth et al., 2011). Por último, Grandner y colaboradores (2010) estudiaron el consumo dietético (a través de cuestionarios) de 459 mujeres postmenopáusicas durante 7 días. El único hallazgo importante de este estudio fue que el consumo de grasas se asoció negativamente con el tiempo total de sueño (Grandner et al., 2010).
Con base en los estudios anteriores, parece que las dietas altas en carbohidratos pueden dar lugar a latencias más cortas de sueño, mientras que las dietas altas en proteínas pueden resultar en una mejor calidad de sueño y las dietas altas en grasas pueden influir negativamente en el tiempo total de sueño. Sin embargo, se necesitan investigaciones adicionales en esta área.
Triptófano
Como se mencionó anteriormente, la síntesis de 5-HT en el cerebro es dependiente de la disponibilidad de su precursor Trp. Además, 5-HT es un precursor de la melatonina en la glándula pineal (Silber y Schmitt, 2010). Se han realizado numerosos estudios que investigan los efectos de la suplementación con triptófano sobre el sueño (para más información, ver Silber y Schmitt, 2010) y parece que dosis de Trp tan bajas como 1 g pueden mejorar la latencia de sueño y la calidad subjetiva del sueño. Esto se puede lograr al consumir ~300 g de pavo o ~200 g de semillas de calabaza.
Melatonina
<15 1978="" acey="" afectar="" al.="" alterando="" aumento="" aunque="" bajos="" br="" calidad="" cantidades="" cil="" conclusiones="" consumo="" consumos="" de="" definitivas="" del="" diario="" dif="" diferencias="" el="" elevado="" en="" es="" este="" estudio="" et="" evidente="" g="" hubo="" inquietud="" la="" lentas.="" los="" mientras="" mostraron="" na="" nas="" no="" normal.="" o.="" o="" obstante="" ondas="" produce="" produjeron="" prote="" puede="" que="" reducidas="" resultados="" sacar="" sue="" tiempo="" total="" un="">La melatonina es una hormona que se asocia con el ritmo circadiano (Morin y Benca, 2012) y algunos estudios han demostrado efectos sedantes/hipnóticos en este compuesto (Buscemi et al., 2005). No obstante, los estudios que investigan el uso de la melatonina para el insomnio primario demuestran resultados poco concluyentes (Morin y Benca, 2012). En un meta-análisis se reportó una reducción en la latencia inicial del sueño de 7.2 min y se concluyó que aunque el uso de melatonina a corto plazo parece ser seguro, no hubo evidencia de su eficacia para los trastornos más primarios del sueño (Buscemi et al., 2005).
Otra intervención recientemente investigada es con el jugo de cereza ácida. Las cerezas ácidas contienen concentraciones altas de melatonina y cuando se consumieron durante un periodo de 2 semanas mejoraron los síntomas de insomnio subjetivo al comparar con un placebo (Pigeon et al., 2010). Asimismo, se han reportado mejorías moderadas en el tiempo y calidad de sueño (Howatson et al., 2011).
Valeriana
La valeriana es una hierba que se une a los receptores GABA tipo A y se cree que induce un efecto calmante general sobre el cuerpo (Wheatley, 2005). Los resultados de un meta-análisis mostraron mejorías subjetivas en la calidad del sueño, pero no en la cantidad (Fernández-San-Martin et al., 2010).
Otras intervenciones nutricionales
Se cree que los nucleótidos están involucrados en la función fisiológica del sueño, en particular el monofosfato de uridina (5’UMP) y el monofosfato de adenosina (5’AMP). El 5’UMP causa un efecto depresivo en el sistema nervioso central y en un estudio donde se administraron dosis bajas antes de dormir se reportaron mejorías en algunos índices del sueño (Chagoya de Sánchez et al., 1996). El 5’AMP tiene propiedades hipnóticas y los niveles de este nucleótido disminuyen durante la vigilia (Sánchez et al., 2009). El 5’AMP actúa en los receptores de adenosina A2A en la región del núcleo venterolateral del cerebro, que se cree que está relacionado con el insomnio, dolor y depresión (Cubero et al., 2009). Estos nucleótidos se han estudiado a través de investigaciones sobre los posibles efectos hipnóticos en fórmulas infantiles (Sánchez et al., 2009). En este estudio, la fórmula de promoción del sueño contenía altos niveles de L-triptófano y carbohidratos, bajos niveles de proteína, 5’UMP y 5’AMP. Se monitorearon cincuenta y cuatro niños durante una semana utilizando actigrafía, mostrando incrementos en el tiempo en cama y aumentos en la eficiencia del sueño. Los autores sugirieron que estos resultados apoyaron el concepto de crononutrición, es decir, la influencia de la hora del día en la cual el alimento se consume tiene efectos en diferentes ritmos biológicos, tales como el sueño y la vigilia. Sin embargo, no se realizaron mediciones en sangre y por lo tanto no fue posible determinar si los compuestos ingeridos fueron transportados desde el sistema digestivo al flujo sanguíneo y cuál de los ingredientes estuvo involucrado activamente en la mejoría del sueño.
La glicina (aminoácido no esencial) funciona como un neurotransmisor inhibidor en el sistema nervioso central y también actúa como un co-agonista de los receptores de glutamato. Se ha demostrado que la glicina mejora el sueño subjetivo en un estudio japonés reciente (Bannai et al., 2012). Yamadera y colaboradores (2007) también reportaron menores latencias iniciales de sueño medidas por polisomnografía (“estándar de oro” para la evaluación del sueño). Los autores especularon a partir de estudios anteriores en roedores, que los mecanismos potenciales podrían involucrar el aumento en la vasodilatación y por lo tanto disminuir la temperatura central y aumentar la liberación de serotonina extracelular en la corteza prefrontal del cerebro (Yamadera et al., 2007).
La L-teanina es un aminoácido análogo presente en el té, pero no en el café, que demuestra acciones farmacológicas tales como la promoción de sentimientos de calma y disminución del estado de alerta. Un estudio reportó que la L-teanina contrarrestó parcialmente la disminución de las ondas lentas de sueño inducida por la cafeína en ratas (Jang et al., 2012).
Asimismo, hay muchos otros productos tradicionales que se han promocionado como inductores del sueño, incluyendo la pasiflora, kava, hierba de San Juan, lisina, magnesio, lavanda, solideo, bálsamo de limón, corteza de magnolia, 5-HTP y GABA. Aunque la mayoría de estos productos no han sido investigados adecuadamente en estudios científicos, muchos se pueden encontrar en los suplementos que ayudan al sueño, los cuales pueden comprarse sin receta médica en farmacias y en tiendas de alimentos saludables. No obstante, al igual que muchos suplementos disponibles, siempre existe el peligro de que estas supuestas ayudas para el sueño puedan contener sustancias ilegales y por lo tanto deben utilizarse con precaución.
APLICACIONES PRÁCTICAS
Los atletas deben enfocarse en tener buenas prácticas para dormir para maximizar el sueño (ver el artículo previo de SSE “El sueño en los atletas de élite”). Debido a que hay poca investigación y algo inconclusa, pueden sugerirse varias recomendaciones prácticas:
Etapas del sueño
El sueño se puede definir como un estado conductual reversible donde un individuo está perceptualmente desconectado del medio ambiente y no responde a él (Carskadon y Demet, 2011). Dormir es un estado conductual y fisiológico complejo que tiene dos estados básicos basados en parámetros fisiológicos. Estos son el estado de movimiento ocular rápido (REM por sus siglas en inglés) y no REM (NREM). Para identificar los dos estados se utiliza un electroencefalograma (EEG), en el que los electrodos miden la actividad eléctrica cerebral (Figura 1). El sueño NREM se divide en cuatro etapas (1-4) que están asociadas con un aumento progresivo de la profundidad del sueño (Carskadon y Dement, 2011). El sueño REM se caracteriza por la atonía muscular, periodos de movimiento ocular rápido y los sueños. Por lo tanto, el sueño REM es un cerebro activo en un cuerpo paralizado.
Medición del sueño
Existen dos métodos utilizados comúnmente para evaluar el sueño. El primero es la actigrafía que involucra monitores en la muñeca, los cuales se ponen como reloj de pulsera que registra continuamente el movimiento corporal (almacenado generalmente en periodos de 1 min), y el registro de diarios del sueño, donde los participantes registran los tiempos iniciales y finales y las fechas de todos los periodos de sueño (es decir, sueño nocturno y siestas durante el día). Los datos de los diarios de sueño y los monitores de actividad se utilizan para determinar cuándo los participantes están despiertos o dormidos. Esencialmente, todo el tiempo se registra como despierto a menos que: (i) el diario de sueño indique que el participante estaba acostado intentando dormir y (ii) la actividad registrada en el monitor es suficientemente baja para indicar que el participante estaba inmóvil. Cuando estas dos condiciones se cumplen de manera simultánea, el tiempo se cuenta como sueño. La actigrafía es útil para entender los patrones de sueño ya que es una forma no invasiva y relativamente fácil de recolectar datos sobre periodos de tiempo significativos (comúnmente 2 semanas de monitoreo).

Figura 1. Se ilustra en el histograma de sueño la progresión de las etapas de sueño a lo largo de una sola noche en un adulto joven voluntario. El texto describe el patrón ideal o promedio (Carskadon y Dement, 2011).
El segundo método es la polisomnografía (PSG), por la cual se miden funciones corporales tales como la actividad cerebral (EEG), movimientos oculares (EOG), actividad muscular (EMG) y actividad cardiaca (ECG). La PSG proporciona información sobre la etapa de sueño y se considera el "patrón de referencia" para la evaluación cuantitativa y cualitativa del sueño. La PSG puede ser costosa, requiere mucho trabajo y generalmente se utiliza para la evaluación clínica de trastornos del sueño.
INTERVENCIONES NUTRICIONALES PARA MEJORAR EL SUEÑO
Existen varios neurotransmisores en el cerebro que están involucrados en el ciclo sueño-vigilia. Estos incluyen a la serotonina, ácido gama aminobutírico (GABA), orexina, hormona concentradora de melanina, colinérgico, galanina, noradrenalina e histamina (Saper et al., 2005). Por lo tanto, es posible que las intervenciones nutricionales que actúan sobre estos neurotransmisores en el cerebro podrían también influir sobre el sueño.
Los precursores dietéticos pueden influenciar la tasa de síntesis y función de un pequeño número de neurotransmisores, incluyendo a la serotonina (Silber y Schmitt, 2010). La Figura 2 de abajo resalta los medios por los cuales la dieta podría influenciar al sistema nervioso central y a través de la producción de serotonina (5-HT) y metionina. La síntesis de 5-HT es dependiente de la disponibilidad de su precursor en el cerebro, el aminoácido L-triptófano (Trp). El Trp se transporta a través de la barrera hematoencefálica por un sistema que comparte otros transportadores que incluyen varios aminoácidos neutros largos (LNAA por sus siglas en inglés). Por lo tanto, el índice de Trp/LNAA en sangre es crucial para el transporte de Trp hacia el cerebro y se puede lograr un incremento en este índice consumiendo triptófano puro o proteína rica en triptófano (Silber y Schmitt, 2010). La proteína proveniente de alimentos con el contenido más alto de Trp y la relación más favorable de Trp:LNAA es la α-lactoalbúmina, una proteína derivada de suero de leche (Heine, 1999). La ingesta de otras formas de proteína generalmente disminuye la absorción de Trp en el cerebro, ya que el Trp es el aminoácido menos abundante y por lo tanto, otros LNAA son transportados preferentemente al interior del cerebro. Sin embargo, los carbohidratos aumentan el Trp en el cerebro mediante la estimulación de la insulina de los LNAA hacia el músculo esquelético, lo que resulta en un incremento del Trp libre (Fernstrom y Wurtman, 1971).
Carbohidratos
Un pequeño número de estudios han investigado los efectos de la ingesta de carbohidratos (CHO) sobre los índices de calidad y cantidad del sueño. Porter y Horne (1981) suministraron a seis sujetos masculinos, ya sea una comida alta en CHO (130 g), una comida baja en CHO (47 g) o una comida que no contenía CHO, 45 minutos antes de dormir. La comida alta en CHO produjo un aumento en el sueño REM y una disminución del sueño ligero y vigilia (Porter y Horne, 1981). No obstante, en este estudio el contenido calórico de las comidas no fue igual por lo que fue imposible decir si el efecto se debió a los carbohidratos o a las calorías.
También se ha estudiado el efecto de la comida vs. bebida (con un contenido alto, medio o bajo de CHO) vs. agua a diversos intervalos de tiempo antes de dormir (Orr et al., 1997). Los resultados demostraron que las comidas sólidas mejoran la latencia inicial del sueño (tiempo necesario para conciliar el sueño) hasta 3 horas después del consumo y las comidas líquidas fueron ligeramente mejores que el agua. No hubo ningún efecto de la composición de la comida o bebida sobre el sueño. A partir de este estudio, no se puede concluir que los efectos observados son efecto de los carbohidratos o de la energía.
Afaghi y colaboradores (2007, 2008) llevaron a cabo dos estudios en los cuales investigaron el consumo de carbohidratos antes de dormir en hombres sanos. En el primer estudio, se dieron comidas con alto o bajo índice glicémico (IG) 4 h o 1 h antes de dormir (Afaghi et al., 2007). La comida con alto IG mejoró significativamente la latencia inicial del sueño en comparación con la de una comida de bajo IG. Además, proporcionar la comida 4 h antes de dormir fue mejor que la comida 1 h antes de dormir. En el segundo estudio, se comparó una comida muy baja en CHO (1% CHO, 61% grasas, 38% proteína) con una comida control (72% de HCO, 12.5% grasas, 15.5% proteína) con la misma energía, 4 h antes de dormir (Afaghi et al., 2008). La comida muy baja en CHO incrementó el porcentaje de tiempo usado en el sueño de ondas lentas (etapas 3 y 4 de NREM) y el tiempo gastado en sueño REM al comparar con la condición control. Finalmente, Jalilolghadr y colaboradores (2011) proporcionaron a ocho niños una bebida con alto IG (200 mL de leche y glucosa) o bajo IG (200 mL de leche y miel), 1 h antes de dormir. En este estudio, la bebida con alto IG aumentó la excitación en mayor medida que la bebida con bajo IG, implicando una baja calidad de sueño.
De la naturaleza limitada y algo contradictoria de los estudios anteriores, parece que los alimentos con alto IG pueden ser beneficiosos si se consumen más de 1 h antes de dormir, y que las comidas sólidas pueden ser mejores que las comidas líquidas para mejorar el sueño.

Figura 2. Efecto de la dieta sobre la absorción de triptófano (Trp) y el sistema nervioso central. Adaptado de Grimmett y Sillence (2005).
Efecto agudo de las comidas con composición mixta
Sólo un pequeño número de estudios han investigado los efectos de las comidas o bebidas de diferente composición sobre el sueño. Hartmann y colaboradores (1979) suministraron una bebida con la cena ya sea alta en grasas (90 g), alta en CHO (223 g) o alta en proteína (30 g). Los resultados no revelaron ningún efecto de las bebidas sobre el sueño al comparar con no consumir ninguna bebida. Zammit y colaboradores (1995) examinaron los efectos de comidas líquidas de alto o bajo contenido de energía (993.5 vs. 306 Kcal) administradas en el almuerzo, en comparación con ninguna comida sobre las siestas durante el día. Se demostró un aumento de tiempo en las etapas 2 y 3 del sueño NREM con ambas comidas líquidas en comparación con ninguna comida. Sin embargo, no hubo diferencias en la latencia inicial de sueño (Zammit et al., 1995).
Una vez más, hay muy poca investigación en esta área, pero parece que la ingesta calórica reducida puede dar lugar a mala calidad de sueño.
Dieta habitual
Los estudios antes mencionados, han examinado las manipulaciones nutricionales agudas en el sueño. También se han llevado a cabo estudios que investigan manipulaciones crónicas o el consumo dietético habitual. Kwan y colaboradores (1986) proporcionaron a seis mujeres sanas, una dieta baja en CHO (50 g/día) por 7 días y reportaron un incremento en la latencia REM en comparación con el patrón de sueño antes de la intervención de 7 días cuando las participantes consumían su dieta habitual. Lacey y colaboradores (1978) también estudiaron mujeres por 7 días, ya sea con un consumo diario alto en proteína, bajo en proteína o normal. Los resultados mostraron que un consumo elevado de proteínas produce un aumento en la inquietud, mientras que consumos bajos de proteína produjeron cantidades reducidas de sueño de ondas lentas. No obstante, no hubo diferencias en el tiempo total de sueño (Lacey et al., 1978). Aunque es difícil sacar conclusiones definitivas de este estudio, es evidente que alterando el consumo diario de proteína puede afectar la calidad del sueño.
En un amplio estudio reciente, Lindseth et al. (2011) manipularon la dieta de 44 adultos por 4 días. Las dietas fueron ya sea altas en proteína, altas en CHO o altas en grasas. Las dietas altas en CHO resultaron en latencias iniciales de sueño más cortas y las dietas altas en proteína produjeron un menor número de episodios de vigilia. Hubo poco efecto de la dieta alta en grasas en los marcadores de la calidad y cantidad de sueño (Lindseth et al., 2011). Por último, Grandner y colaboradores (2010) estudiaron el consumo dietético (a través de cuestionarios) de 459 mujeres postmenopáusicas durante 7 días. El único hallazgo importante de este estudio fue que el consumo de grasas se asoció negativamente con el tiempo total de sueño (Grandner et al., 2010).
Con base en los estudios anteriores, parece que las dietas altas en carbohidratos pueden dar lugar a latencias más cortas de sueño, mientras que las dietas altas en proteínas pueden resultar en una mejor calidad de sueño y las dietas altas en grasas pueden influir negativamente en el tiempo total de sueño. Sin embargo, se necesitan investigaciones adicionales en esta área.
Triptófano
Como se mencionó anteriormente, la síntesis de 5-HT en el cerebro es dependiente de la disponibilidad de su precursor Trp. Además, 5-HT es un precursor de la melatonina en la glándula pineal (Silber y Schmitt, 2010). Se han realizado numerosos estudios que investigan los efectos de la suplementación con triptófano sobre el sueño (para más información, ver Silber y Schmitt, 2010) y parece que dosis de Trp tan bajas como 1 g pueden mejorar la latencia de sueño y la calidad subjetiva del sueño. Esto se puede lograr al consumir ~300 g de pavo o ~200 g de semillas de calabaza.
Melatonina
<15 1978="" acey="" afectar="" al.="" alterando="" aumento="" aunque="" bajos="" br="" calidad="" cantidades="" cil="" conclusiones="" consumo="" consumos="" de="" definitivas="" del="" diario="" dif="" diferencias="" el="" elevado="" en="" es="" este="" estudio="" et="" evidente="" g="" hubo="" inquietud="" la="" lentas.="" los="" mientras="" mostraron="" na="" nas="" no="" normal.="" o.="" o="" obstante="" ondas="" produce="" produjeron="" prote="" puede="" que="" reducidas="" resultados="" sacar="" sue="" tiempo="" total="" un="">La melatonina es una hormona que se asocia con el ritmo circadiano (Morin y Benca, 2012) y algunos estudios han demostrado efectos sedantes/hipnóticos en este compuesto (Buscemi et al., 2005). No obstante, los estudios que investigan el uso de la melatonina para el insomnio primario demuestran resultados poco concluyentes (Morin y Benca, 2012). En un meta-análisis se reportó una reducción en la latencia inicial del sueño de 7.2 min y se concluyó que aunque el uso de melatonina a corto plazo parece ser seguro, no hubo evidencia de su eficacia para los trastornos más primarios del sueño (Buscemi et al., 2005).
Otra intervención recientemente investigada es con el jugo de cereza ácida. Las cerezas ácidas contienen concentraciones altas de melatonina y cuando se consumieron durante un periodo de 2 semanas mejoraron los síntomas de insomnio subjetivo al comparar con un placebo (Pigeon et al., 2010). Asimismo, se han reportado mejorías moderadas en el tiempo y calidad de sueño (Howatson et al., 2011).
Valeriana
La valeriana es una hierba que se une a los receptores GABA tipo A y se cree que induce un efecto calmante general sobre el cuerpo (Wheatley, 2005). Los resultados de un meta-análisis mostraron mejorías subjetivas en la calidad del sueño, pero no en la cantidad (Fernández-San-Martin et al., 2010).
Otras intervenciones nutricionales
Se cree que los nucleótidos están involucrados en la función fisiológica del sueño, en particular el monofosfato de uridina (5’UMP) y el monofosfato de adenosina (5’AMP). El 5’UMP causa un efecto depresivo en el sistema nervioso central y en un estudio donde se administraron dosis bajas antes de dormir se reportaron mejorías en algunos índices del sueño (Chagoya de Sánchez et al., 1996). El 5’AMP tiene propiedades hipnóticas y los niveles de este nucleótido disminuyen durante la vigilia (Sánchez et al., 2009). El 5’AMP actúa en los receptores de adenosina A2A en la región del núcleo venterolateral del cerebro, que se cree que está relacionado con el insomnio, dolor y depresión (Cubero et al., 2009). Estos nucleótidos se han estudiado a través de investigaciones sobre los posibles efectos hipnóticos en fórmulas infantiles (Sánchez et al., 2009). En este estudio, la fórmula de promoción del sueño contenía altos niveles de L-triptófano y carbohidratos, bajos niveles de proteína, 5’UMP y 5’AMP. Se monitorearon cincuenta y cuatro niños durante una semana utilizando actigrafía, mostrando incrementos en el tiempo en cama y aumentos en la eficiencia del sueño. Los autores sugirieron que estos resultados apoyaron el concepto de crononutrición, es decir, la influencia de la hora del día en la cual el alimento se consume tiene efectos en diferentes ritmos biológicos, tales como el sueño y la vigilia. Sin embargo, no se realizaron mediciones en sangre y por lo tanto no fue posible determinar si los compuestos ingeridos fueron transportados desde el sistema digestivo al flujo sanguíneo y cuál de los ingredientes estuvo involucrado activamente en la mejoría del sueño.
La glicina (aminoácido no esencial) funciona como un neurotransmisor inhibidor en el sistema nervioso central y también actúa como un co-agonista de los receptores de glutamato. Se ha demostrado que la glicina mejora el sueño subjetivo en un estudio japonés reciente (Bannai et al., 2012). Yamadera y colaboradores (2007) también reportaron menores latencias iniciales de sueño medidas por polisomnografía (“estándar de oro” para la evaluación del sueño). Los autores especularon a partir de estudios anteriores en roedores, que los mecanismos potenciales podrían involucrar el aumento en la vasodilatación y por lo tanto disminuir la temperatura central y aumentar la liberación de serotonina extracelular en la corteza prefrontal del cerebro (Yamadera et al., 2007).
La L-teanina es un aminoácido análogo presente en el té, pero no en el café, que demuestra acciones farmacológicas tales como la promoción de sentimientos de calma y disminución del estado de alerta. Un estudio reportó que la L-teanina contrarrestó parcialmente la disminución de las ondas lentas de sueño inducida por la cafeína en ratas (Jang et al., 2012).
Asimismo, hay muchos otros productos tradicionales que se han promocionado como inductores del sueño, incluyendo la pasiflora, kava, hierba de San Juan, lisina, magnesio, lavanda, solideo, bálsamo de limón, corteza de magnolia, 5-HTP y GABA. Aunque la mayoría de estos productos no han sido investigados adecuadamente en estudios científicos, muchos se pueden encontrar en los suplementos que ayudan al sueño, los cuales pueden comprarse sin receta médica en farmacias y en tiendas de alimentos saludables. No obstante, al igual que muchos suplementos disponibles, siempre existe el peligro de que estas supuestas ayudas para el sueño puedan contener sustancias ilegales y por lo tanto deben utilizarse con precaución.
APLICACIONES PRÁCTICAS
Los atletas deben enfocarse en tener buenas prácticas para dormir para maximizar el sueño (ver el artículo previo de SSE “El sueño en los atletas de élite”). Debido a que hay poca investigación y algo inconclusa, pueden sugerirse varias recomendaciones prácticas:
- Alimentos con alto IG, tales como el arroz blanco, la pasta, pan y papa pueden promover el sueño. Sin embargo, deben consumirse más de una hora antes de dormir.
- Las dietas altas en carbohidratos pueden dar lugar a latencias de sueño más cortas.
- Las dietas altas en proteína pueden resultar en una mejoría en la calidad del sueño.
- Las dietas altas en grasas pueden influenciar negativamente el tiempo total de sueño.
- Cuando se disminuye el consumo calórico total, se puede perjudicar la calidad del sueño.
- Pequeñas cantidades de triptófano (1 g) pueden mejorar tanto la latencia como la calidad del sueño. Esto puede lograrse consumiendo ~300g de pavo o ~200g de semillas de calabaza.
- La hormona melatonina y los alimentos que tienen concentraciones altas de melatonina podrían disminuir el tiempo inicial de sueño.
- La calidad subjetiva del sueño puede mejorar consumiendo la hierba valeriana.
RESUMEN
Si bien, la cantidad de investigación sobre los efectos de las intervenciones nutricionales en el sueño es cada vez mayor, se necesita que los estudios futuros destaquen la importancia de las intervenciones nutricionales y dietéticas para mejorar el sueño tanto en la población general como en los atletas. La evaluación cuidadosa tanto del momento de consumo de alimentos como del uso de diferentes intervenciones proporcionaría información valiosa a los atletas sobre cómo mejorar el sueño a través de la nutrición. Lo ideal sería que la investigación llevara a intervenciones nutricionales para optimizar la calidad y cantidad de sueño, así como mejorar la recuperación del atleta de los entrenamientos y competencias.
Si bien, la cantidad de investigación sobre los efectos de las intervenciones nutricionales en el sueño es cada vez mayor, se necesita que los estudios futuros destaquen la importancia de las intervenciones nutricionales y dietéticas para mejorar el sueño tanto en la población general como en los atletas. La evaluación cuidadosa tanto del momento de consumo de alimentos como del uso de diferentes intervenciones proporcionaría información valiosa a los atletas sobre cómo mejorar el sueño a través de la nutrición. Lo ideal sería que la investigación llevara a intervenciones nutricionales para optimizar la calidad y cantidad de sueño, así como mejorar la recuperación del atleta de los entrenamientos y competencias.


